引言
高一化学作为高中化学学习的起点,其重要性不言而喻。为了帮助学生更好地理解和掌握化学知识,本文将为您呈现高一化学专题4的思维导图,帮助同学们梳理学习思路,提高学习效率。
专题4概述
高一化学专题4主要涵盖了原子结构、化学键、溶液、电解质等内容。这些内容是化学学习的基础,对于后续学习具有重要的铺垫作用。
原子结构
原子结构是化学学习的基石。在思维导图中,我们可以将其分为以下几个部分:
- 原子模型:从道尔顿的原子论到卢瑟福的原子核模型,再到玻尔的量子力学模型,逐步了解原子的结构。
- 原子核:原子核由质子和中子组成,了解质子数和原子序数的关系。
- 电子层:电子层分为K、L、M、N等,了解电子层的特点和电子排布规律。
- 元素周期表:元素周期表是化学学习的有力工具,了解元素周期律和周期表的结构。
化学键
化学键是原子间相互作用的力,分为离子键、共价键和金属键。在思维导图中,我们可以这样表示:
- 离子键:由正负离子通过静电引力结合而成,如NaCl。
- 共价键:由两个原子共享电子对形成,如H2。
- 金属键:金属原子通过自由电子云相互吸引,如Fe。
溶液
溶液是由溶质和溶剂组成的均一混合物。在思维导图中,我们可以从以下几个方面进行学习:
- 溶质:溶质可以是固体、液体或气体。
- 溶剂:溶剂通常是液体,如水。
- 溶解度:溶解度是指在一定温度下,单位溶剂中能溶解的溶质的最大量。
- 饱和溶液:饱和溶液是指在一定温度下,溶质已达到最大溶解度的溶液。
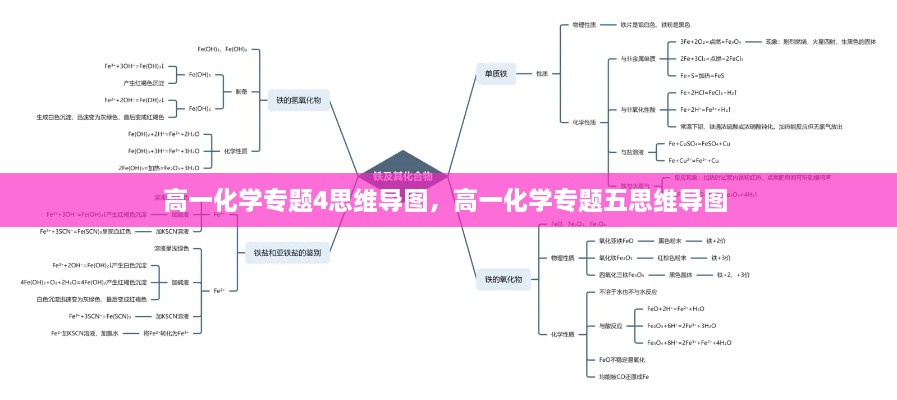
电解质
电解质是指在水溶液中或熔融状态下能够导电的化合物。在思维导图中,我们可以将其分为以下几类:
- 强电解质:在水溶液中完全电离,如NaCl。
- 弱电解质:在水溶液中部分电离,如CH3COOH。
- 非电解质:在水溶液中不导电,如C6H12O6。
总结
通过以上思维导图,我们可以清晰地了解到高一化学专题4的知识体系。在学习过程中,同学们可以根据思维导图进行复习和巩固,有助于提高学习效果。同时,建议同学们在学习过程中,注重理论与实践相结合,多做实验,加深对化学知识的理解。
转载请注明来自泰安空气能_新泰光伏发电_泰安空气能厂家|品质保障,本文标题:《高一化学专题4思维导图,高一化学专题五思维导图 》
百度分享代码,如果开启HTTPS请参考李洋个人博客







 蜀ICP备2022005971号-1
蜀ICP备2022005971号-1
还没有评论,来说两句吧...